Edición del ADN: una nueva era en la medicina
En 1978, una bacteria llamada Escherichia coli empezaba a producir insulina humana. Era el primer organismo que producía comercialmente una molécula que le pertenecía a otra especie. Esta gran hazaña de la biotecnología lo hizo la empresa Genetech en colaboración con el Centro Médico City of Hope, la que permitió reemplazar a la costosa insulina aislada y purificada del páncreas de los cerdos y bovinos que eran sacrificados para la alimentación humana. Se requería al menos 8.000 kilos de páncreas para obtener un kilo de insulina.
Insulina derivada de bacterias genéticamente modificadas. Fuente: Wikimedia Commons.
Estas primeras herramientas de ingeniería genética eran un poco rudimentarias: no se tenía control sobre el lugar donde el gen se integraba dentro del genoma del organismo receptor. No obstante, gracias a ella se desarrollaron cultivos resistentes a insectos, cabras que producen proteínas humanas en su leche y plantas que producen anticuerpos contra el Ébola. Pero el problema de la aleatoriedad del proceso aumentaba los costos al momento de seleccionar a los organismos adecuados y provocaba algunos efectos no deseados en ellos.
A fines de la década de 1980, un grupo de investigadores japoneses, liderados por el Dr. Atsuo Nakata, encontraron —por pura casualidad— unas porciones de ADN de 29 letras que se repetían constantemente cada 32 letras mientras estudiaban el gen de una enzima de E. coli. Para ellos era algo curioso pero sin importancia y nada hacía presagiar que este sería el inicio de toda una revolución en la ingeniería genética.
En el 2002, investigadores holandeses descubrieron que estas secuencias repetidas estaban asociadas a genes que codificaban para unas moléculas capaces de cortar el ADN llamadas nucleasas Cas (cas9 es una de ellas), cuyo funcionamiento recién se comprendió en el 2008.
Las secuencias repetidas (llamadas CRISPR en la jerga científica) eran idénticas a fragmentos de ADN de virus que previamente habían infectado a las bacterias. Las CRISPR se transforman en ARN y se unen a las nucleasas Cas9. Una vez que el virus infecta a la bacteria, el complejo CRISPR-Cas lo reconoce y degrada su ADN. En otras palabras, este vendría a ser el sistema inmune de las bacterias.
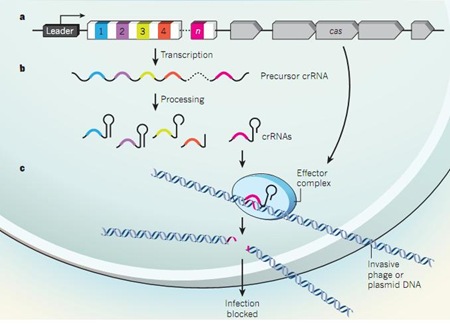
a) Secuencias repetidas (1, 2, 3, 4…) interespaciadas y genes que codifican la nuecleasa Cas. b) Transcripción en ARN de las secuencias repetidas. c) Ensamblaje de las moléculas de ARN con la nuecleasa Cas9 para cortar el ADN viral. Fuente: Nature.
Es en este punto donde dos científicas que investigaban a fondo el funcionamiento del complejo CRISPR-Cas, Emmanuelle Charpentier de la Umeå University en Suecia y Jennifer Doudna de la Universidad de California Berkeley, se encontraron en un congreso científico celebrado en Puerto Rico en el 2011 y unieron fuerzas. Se dieron cuenta que pueden usar este mecanismo para editar genes a través de cortes en regiones específicas del ADN.
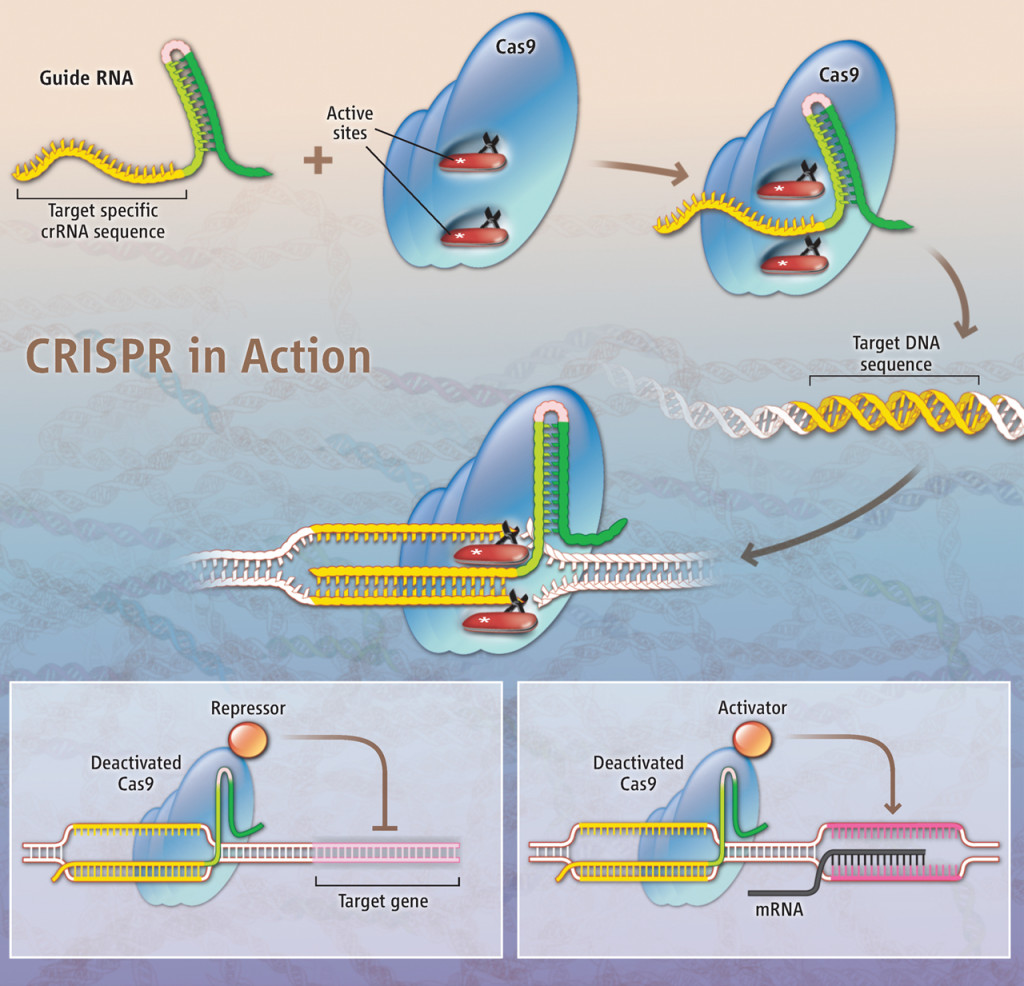
Sistema CRISPR/Cas9 Fuente: E. Pennisi, Science, 341:833-6, 2013. Credito: K. Sutliff/Science
Charpentier y Doudna demostraron que las nucleasas Cas9 abren las cadenas de ADN por la mitad —como si fuera una cremallera— y avanza en busca de una secuencia que sea complementaria a la molécula de ARN que lleva acoplada. Cuando la encuentra se produce el corte. Y no solo eso, uno puede diseñar y reemplazar esa molécula de ARN acoplada a Cas9 para que reconozca otras secuencias de ADN que sean de nuestro interés, de genes que queremos eliminar, editar, modificar, etc., en cualquier organismo. Finalmente, esta idea se hizo realidad en el 2012.
Aquí un vídeo animado, aunque está en inglés, podrán comprender mejor como funciona este mecanismo a través de la animación:
El uso del sistema CRISPR-Cas para editar genes, sin dudas, es una de las mayores revoluciones en la ingeniería genética de los últimos 30 años (cuando se desarrolló la primera bacteria recombinante). Las posibilidades que abren son grandes, incluso algunos piensan que se puede editar el genoma de los humanos o de los elefantes y traer a la vida a los Neandertales y al mamut, cuyos genomas fueron secuenciados hace pocos años.
Y no solo eso, esta tecnología abre posibilidades terapéuticas, tanto así que el año pasado, la Dra. Doudna y otros investigadores del Instituto Tecnológico de Massachusetts (MIT) han fundado la empresa Editas Medicine con un presupuesto de 43 millones de dólares para el desarrollo de fármacos basados en el sistema CRISPR-Cas. Asimismo, en Basilea y Londres se fundó la empresa CRISPR Therapeutics con un presupuesto de 25 millones de dólares para alcanzar el mismo objetivo.
Por ahora, estas empresas biotecnológicas están enfocadas al desarrollo de animales de laboratorio (ratas, conejos, ratones, etc.) genéticamente modificados a través de la tecnología CRISPR-Cas. Por ejemplo, a través de la página web de SAGE (empresa que obtuvo la licencia de Editas Medicine para usar la tecnología) uno puede pedir un determinado número de ratones sin el gen Pink1 el cual es usado para el estudio de la enfermedad de Parkinson y el desarrollo de nuevos fármacos para tratar esta enfermedad neurodegenerativa. Otros pedidos se enfocan al desarrollo de ratas que poseen genes humanos específicos, asociados a diferentes enfermedades, para ver cómo funcionan.
Para desarrollar uno de estos animales, digamos un ratón sin el gen Pink1, la empresa SAGE diseña moléculas de ARN complementarias a los genes que se quieren suprimir. Luego, lo ensamblan a la nucleasa Cas9 y, finalmente, prueban si la herramienta funciona introduciéndola mediante una corriente eléctrica en las células del animal cultivadas en el laboratorio. Si funciona, hacen lo mismo pero en los embriones que después implantan en “vientres de alquiler” de otras ratonas y, al cabo de unas semanas, tienen una camada de ratones sin el gen Pink1.
Con las técnicas convencionales, este proceso podía tomar varios años y costar millones de dólares, ahora solo se requiere de unos pocos meses y miles de dólares.
Pero esta herramienta, al igual que otras relacionadas con la ingeniería genética, ha abierto un nuevo dilema ético. Por ejemplo, ¿sería ético modificar los genes de especies existentes para traer a la vida a sus parientes cercanos que ya se han extinto (ej: el mamut, los neandertales, el dodo, etc.)? ¿Sería ético ajustar la anormalidad cromosómica de un bebe en desarrollo con el síndrome de Down, que tiene tres cromosomas 21 en vez de dos, antes de que nazca? ¿Sería ético usar la herramienta para extinguir poblaciones de insectos que transmiten enfermedades como la malaria?
Estos temas deben evaluarse. Pero por el momento, la herramienta ha demostrado ser capaz de corregir enfermedades genéticas. En junio de este año, investigadores del MIT usaron la tecnología CRISPR-Cas para curar a un ratón de una extraña enfermedad hepática llamada tirosinemia, a través de la corrección del gen defectuoso en las células del hígado. Y un mes después, el Dr. Kamel Khalili logró extirpar el VIH de diferentes células infectadas en el laboratorio.
Sin dudas, estamos entrando a una nueva era en la medicina.
Referencia:
Margaret Knox. The Gene Genie Scientific American Diciembre 2014, pp: 42-46.

:quality(75)/2.blogs.elcomercio.pe/service/img/expresiongenetica/autor.jpg)