El año de la edición de genes
Como es costumbre por estas fechas, todos los medios de comunicación científica lanzan sus resúmenes anuales, sus “top 10″ o ”lo mejor del 2015″, y casi todos coinciden en tres cosas: los descubrimientos en Marte, especialmente, las sales hidratadas que aparecen en ciertas épocas del año; la visita de New Horizons a Plutón y la edición de genes mediada por CRISPR/Cas9. Yo me enfocaré en esta última que, para la revista Science, fue el suceso científico del año.
¿Qué es CRISPR/Cas9?
Hablar de ADN y genes siempre resulta ser muy abstracto. Así que usaremos un ejemplo cotidiano para tener una idea de lo que es y lo que hace esta herramienta molecular.
Imagina que durante el mes de noviembre has preparado un ensayo de 10.000 palabras sobre los gastos que realizan los peruanos durante las épocas navideñas. De pronto te enteras que la denominación de nuestra moneda cambió de “nuevos soles” a “soles”. Como eres muy cuidadoso con los detalles, quieres que tu texto también refleje ese cambio antes de publicarlo.
Una forma de hacer los cambios es leer todo el texto y borrar la palabra “nuevos” cada vez que la encuentres. Te tomará varios minutos y correrás el riesgo de que por ahí se te pase alguno sin que te des cuenta. Pero MS Word cuenta con una herramienta llamada “buscar y reemplazar” que hace el mismo trabajo en cuestión de segundos. Simplemente pones la palabra que quieres que busque (“nuevos soles”) y pones la palabra por la que quieres que la reemplace (“soles”).
Ahora asume que el ensayo vendría a ser nuestro genoma, el cual está conformado por 3000 millones de nucleótidos (caracteres) que codifican unos 20.000 genes (palabras).
Hay genes que pueden presentar errores (mutaciones) —o palabras mal escritas— y provocar catástrofes en nuestro organismo —como los errores ortográficos producen en el texto. Por ejemplo, la anemia falciforme es una enfermedad causada por el cambio de un nucleótido de los 1606 que conforman el gen de la globina beta (componente de la hemoglobina, que es responsable de transportar el oxígeno en la sangre). Los glóbulos rojos, en vez de ser esféricos, adquieren una forma de hoz, provocando diversos problemas en la persona.
A través del sistema CRISPR/Cas9 podemos editar y corregir esta mutación. Para ello usamos una secuencia de ARN guía que es complementaria a la porción del gen de la globina beta donde se encuentra el error (esto sería la función “buscar” del MS Word) y con la ayuda de la nucleasa Cas9 (una enzima que corta el ADN) eliminamos esa región y la cambiamos por la versión correcta (esto sería la función “reemplazar” del MS Word).
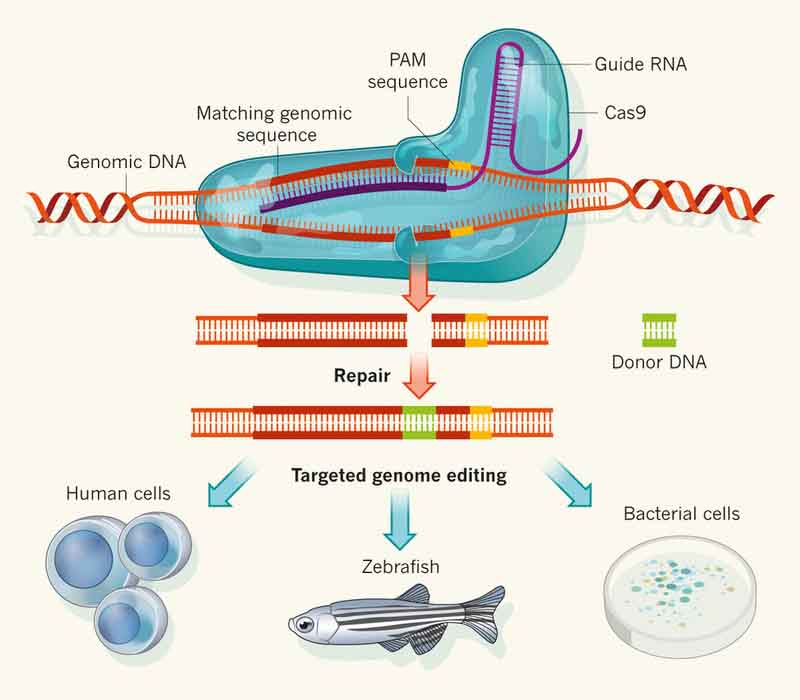
Fuente: Nature Biotechnology.
Esta herramienta también nos permite eliminar genes enteros, insertar nuevos y mejorar los existentes [aquí un video]. Solo basta con diseñar la secuencia de ARN guía para que ubique la región del ADN que queremos editar. Por ejemplo, hace poco, un grupo de investigadores estadounidenses desarrollaron cerdos inmunes al virus del síndrome reproductivo y respiratorio porcino (SRRP) a través de la eliminación del gen que codifica la proteína CD163, que es usada por el agente infeccioso para reconocer e infectar las células del animal.
¿Qué hay de los humanos?
El ejemplo de la anemia falciforme es hipotético. Precisamente, a inicios de este mes, en Washington, se realizó el Congreso Internacional sobre Edición Genética Humana, organizada por las academias de ciencias de los Estados Unidos, Reino Unido y China.
La principal conclusión a la que llegaron los más de 500 asistentes, entre los que se encontraban los descubridores del sistema CRISPR/Cas9 como Emanuelle Charpentier, Jennifer Doudna y Feng Zhang, fue de evitar el uso de la tecnología en células germinales (las que producen los óvulos y espermatozoides) y embrionarias (las que produzcan un embarazo viable) hasta que los problemas éticos y de seguridad sean resueltos.
Dilemas éticos
La tecnología tiene el potencial de corregir mutaciones que provocan diversas enfermedades genéticas, tales como: la enfermedad de Huntington, la anemia falciforme o la fibrodisplacia oscificante progresiva. En estos tres casos, por ejemplo, la enfermedad se debe a errores en un solo gen que de alguna manera podrían ser “fácilmente” corregidos antes del embarazo. ¿Qué padre no quisiera que su hijo nazca sano si tiene la posibilidad de hacerlo?
El tema viene cuando se quiera usar la tecnología para editar genes asociados con la inteligencia, las prestaciones físicas, la inmunidad a ciertos agentes infecciosos como el VIH o diversos rasgos fenotípicos como el color de ojos, piel y cabello. ¿Esto aumentaría las desigualdades y discriminación entre las poblaciones?
La “mejora” de los rasgos humanos no es una idea novedosa. Ya desde la antigua Grecia se creía que la reproducción humana debía ser controlada por el gobierno, es decir, que sólo a los mejores ciudadanos se les permitiría reproducirse.
Fue recién en 1865 cuando Francis Galton plantó la idea de la eugenesia seriamente a través de un artículo publicado en una revista generalista en la cual decía: “Si la veinteava parte del coste y esfuerzo que se gasta en la mejora de la cría de caballos y ganado se empleara en la mejora de la raza humana, ¡qué galaxia de genios se podría crear!”.
Las ideas de Galton calaron muy fuerte en algunas sociedades hasta el punto de dictaminar leyes y políticas para realizar esterilizaciones forzadas a delincuentes, prostitutas, epilépticos, sifilíticos y personas consideradas deficientes mentales.

Cartel promoviendo la eliminación de las “deficiencias” genéticas en EEUU. Fuente: Wikimedia Commons.
Con el desarrollo de la fecundación in vitro, el empresario Robert Klark Graham fundó el Depósito de Hermann J. Muller para la Opción Germinal en 1979, donde se almacenaría el esperma de ganadores de premios Nobel que estaría a disposición de las mujeres que quisieran tener un hijo de alguno de estos genios. Cinco años después, sumó como donantes a atletas olímpicos exitosos. Al momento que se cerró este banco de semen, en 1999, más de 200 niños ya habían sido engendrados.
El desarrollo de la ingeniería genética, a mediados de la década de 1980, ponía de nuevo a la eugenesia sobre el tapete y se desarrollaba la idea de los bebés de diseño y la terapia génica. Sin embargo, la aleatoriedad del proceso y la incapacidad de controlar el lugar de inserción de los genes en el ADN humano, han frustrado su aplicabilidad.
Ahora contamos con una herramienta muy precisa y económica para editar y modificar nuestros genes. Los avances tecnológicos permiten secuenciar y ensamblar genomas enteros en un par de días y por menos de $10.000. Podemos identificar mutaciones rápidamente.
Sin embargo, creer que se pueden desarrollar bebés “a la carta” hoy en día solo muestra ignorancia sobre cómo funcionan realmente los genes. El producto de expresión de un gen puede estar involucrado en distintas funciones biológicas a la vez, muchas de ellas, vitales para el organismo.
Seguridad de la técnica
El sistema CRISPR/Cas9 ha demostrado ser una poderosa herramienta para la edición de genes. Ha funcionado de maravilla en bacterias, plantas y animales, incluso en cultivos de células humanas. Sin embargo, cuando se hizo el primer experimento en embriones humanos en China, menos del 5% lograron ser editados correctamente.
Los investigadores observaron que el sistema CRISPR/Cas9, a veces, perdía su objetivo e insertaba la modificación genética en lugares equivocados. Haciendo una analogía con el MS Word, es como si pusiéramos buscar la palabra “cabello” y la herramienta no pudiera diferenciarlo de “caballo”, por ser muy parecidos. Entonces, para poder aplicar la técnica con seguridad, el sistema CRISPR/Cas9 debe ser 100% específico. Un 99,9% no es considerado seguro porque podríamos alterar genes correctos.
Otra observación que hicieron fue que los embriones se convertían en una especie de mosaico, donde algunas de sus células tenían el gen editado y otras no.
Si bien es cierto, casi todos los países del mundo tienen restricciones para hacer modificaciones genéticas de embriones humanos, los chinos no. Para ellos la persona comienza con el nacimiento y termina con la muerte (de acuerdo al confucianismo), por lo que ni el embrión humano ni el feto, son una persona.
Para concluir, el sistema CRISPR/Cas9 tiene un enorme potencial en muchas áreas de la actividad humana: el desarrollo de cultivos capaces de tolerar los efectos del cambio climático, el desarrollo de nuevos medicamentos, la biorremediación de suelos y aguas contaminadas, el tratamiento de ciertas enfermedades como la leucemia, etc., por lo que es importante discutir abiertamente las cuestiones éticas y las mecanismos para regularlo.

:quality(75)/2.blogs.elcomercio.pe/service/img/expresiongenetica/autor.jpg)