La ingeniería genética contra el asesino más mortal
Para los que vivimos en zonas urbanas, los mosquitos solo son una molestia en las noches cálidas de verano o durante un fin de semana en el campo. Pero estos insectos matan a 750 mil personas cada año. Ni siquiera la suma de todas las víctimas de homicidio en el mundo alcanzan este número. ¿Qué los hace tan letales?
Los mosquitos son vectores de verdaderas “armas biológicas”. El grupo Anopheles spp. transmite plasmodios, los parásitos responsables de la malaria que causan la muerte de casi medio millón de personas al año. Los Aedes spp. inoculan los virus de la fiebre amarilla, dengue, zika, chikungunya, entre otros. Y las Lutzomyia spp. inyectan leishmanias y bartonelas (causante de la enfermedad de Carrión). Al menos la mitad de la población mundial está en riesgo de contraer alguno de ellos.
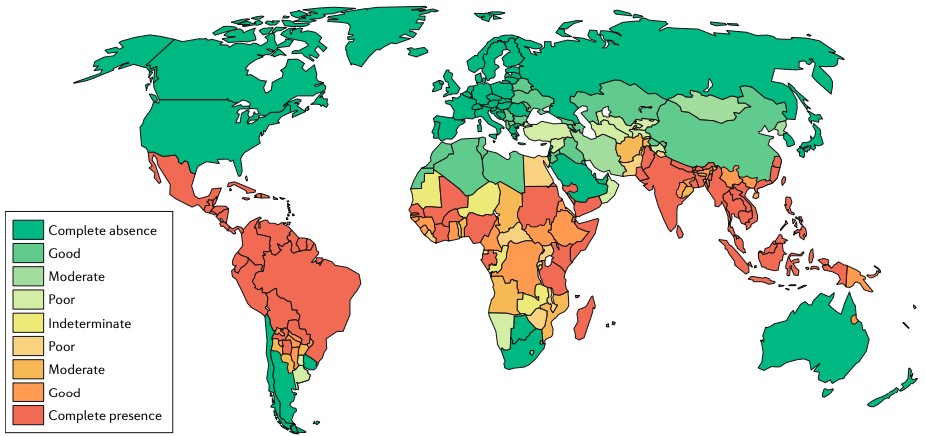
Presencia de Aedes en el mundo. Fuente: Nat Rev Microb 16, 508–518 (2018).
Hasta ahora, la mejor defensa contra la picadura de mosquitos —y, por tanto, la transmisión de diversas enfermedades— es la fumigación de viviendas y el uso de mosquiteros impregnados con insecticidas. Sin embargo, su eficacia se reduce. Los mosquitos evolucionan y se vuelven más resistentes. Requerimos de nuevas estrategias para enfrentar este problema y la ingeniería genética puede ser una de ellas.
La técnica de los insectos estériles es un método de control de plagas eficiente. En el Perú se usa para erradicar la mosca de la fruta (Ceratitis capitata). Para ello, se aplica radiación gamma a las pupas de la mosca (solo a los machos) para infringir daño en sus órganos reproductivos. Son esterilizados. Una vez completan su desarrollo, son liberados al ambiente en una proporción de 10 a 1 con relación a los machos silvestres. Por su número, tienen ventaja al momento de copular con las hembras, quienes solo lo hacen una vez. Sin embargo, los huevos nunca llegan a fertilizarse. No nacen más moscas de la fruta y su población decrece.
El problema con esta técnica es que no puede aplicarse a todas las especies de mosquitos. En el caso de los Aedes y Anopheles, la competitividad de los machos se reduce considerablemente.
La ingeniería genética puede desarrollar mosquitos estériles de una forma más eficiente y sin afectar su competitividad. En vez de usar radiación ionizante —que no solo afecta el desarrollo de las gónadas masculinas sino también otros órganos— se puede inactivar un gen clave para el desarrollo del esperma.
En el año 2002, la empresa británica Oxitec desarrolló los mosquitos OX513A de Aedes aegypti. Mediante la ingeniería genética, le introdujeron un gen que produce una sustancia tóxica que solo se activa en la fase de larva. Estos mosquitos no son estériles. Pueden fertilizar los huevos de las hembras y, al hacerlo, transmiten el gen letal. Los huevos eclosionan y, al poco tiempo, las larvas mueren.
Los mosquitos OX513A fueron probados en algunas localidades de Islas Caimán, Brasil y Panamá, reduciendo más del 90 % las poblaciones de mosquitos. Sin embargo, no hay datos sobre la reducción de casos de enfermedades transmitidas por ellos (dengue, zika y chikungunya); que son el objetivo para el cual fueron desarrollados.

Lugares de experimentación y resultados obtenidos. Fuente: Oxitec.
La empresa Oxitec trabaja en la segunda generación de mosquitos transgénicos. Se llaman OX5034 y, a diferencia de su predecesor, el gen letal solo elimina las larvas hembras, porque son estas —y no los machos— las que pican a los seres humanos.
Lamentablemente, esta tecnología tiene desventajas. Para lograr la eliminación de mosquitos de un área, se debe liberar millones de machos transgénicos cada semana por un largo período de tiempo. Y, para evitar el resurgimiento de nuevas poblaciones por la migración de mosquitos desde otras regiones, las liberaciones tienen que repertirse periódicamente. Además, la presencia de tetraciclina en el ambiente por el uso excesivo de antibióticos puede inactivar el gen de letalidad y las larvas lograrían desarrollarse.
Existen nuevas estrategias en desarrollo. Se han identificado genes que atacan al patógeno y que al introducirlos en los mosquitos evitan su transmisión. También se conocen los genes involucrados en la reproducción o en la distorsión sexual. La dificultad radica en cómo diseminar los genes a todos los mosquitos en una población.
En 1995, se descubren las secuencias HEG (genes de endonucleasas homing, por sus siglas en inglés) en el genoma de muchos organismos. Estas endonucleasas son enzimas que reconocen lugares específicos del ADN y lo cortan. Su particularidad es que para reparar el corte utilizan la misma secuencia HEG como molde. De esta forma, donde había una copia de HEG (heterocigota), ahora hay dos (homocigota). Esto garantiza que todos sus descendientes porten la secuencia HEG y el proceso se repite. A esta técnica se le conoce como gen drive (genes dirigidos o impulsores genéticos).
Los investigadores vieron en HEG un mecanismo para inactivar genes en toda una población de mosquitos. Podían diseñar una endonucleasa capaz de reconocer, cortar e introducir la secuencia HEG en medio de genes esenciales para el desarrollo de los órganos reproductivos o para la transmisión de los agentes infecciosos. Se hicieron algunos trabajos experimentales hasta que, en 2010, surgió el sistema CRISPR-Cas9.
A diferencia de HEG, este sistema utiliza una pequeña secuencia de ARN —que es mucho más fácil de diseñar— para guiar el lugar donde la nucleasa Cas9 hará el corte del ADN. De esta forma, no solo se puede inactivar cualquier gen de un organismo (como los responsables de la fertilidad de las hembras para reducir la población de mosquitos), sino también introducir nuevas características (como aquellos que bloquean la proliferación de los agentes infecciosos para volverlos resistentes a los virus) que pueden ser heredadas al 100 % de los descendientes.
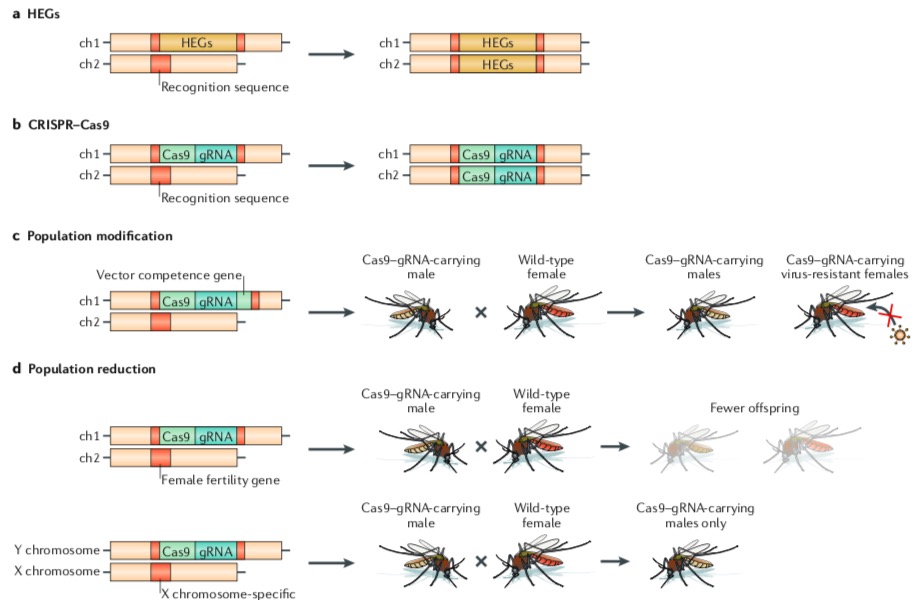
Estrategias basadas en gen drive. Fuente: Nat Rev Microb 16, 508–518 (2018).
Las estrategias basadas en HEG o CRISPR-Cas9, si bien son más simples y en teoría más eficaces, también son susceptibles a la aparición de resistencias por mutaciones en las secuencias de reconocimiento. Se deben diseñar endonucleasas o ARN guías para varios objetivos que funcionen en simultáneo.
Por otro lado, es difícil predecir el efecto que tendrá modificar las poblaciones de mosquitos en el ecosistema. Es necesario siempre la evaluación de riesgos y las liberaciones controladas que aportan datos de bioseguridad relevantes. Y si usamos la tecnología para eliminar a los mosquitos transmisores de enfermedades, ¿sería ético extinguir una especie para nuestro beneficio?

:quality(75)/2.blogs.elcomercio.pe/service/img/expresiongenetica/autor.jpg)