¿Humanos genéticamente modificados? No tan rápido
Quién diría que el descubrimiento del mecanismo de defensa de las bacterias frente a los virus, hace menos de una década, hoy nos permita tener una herramienta simple, económica y extraordinariamente efectiva para modificar el ADN de un organismo, incluso, del ser humano.
Quiero recalcar que este es un claro ejemplo de por qué se debe invertir en ciencia básica. No solo permite «saciar la curiosidad» que tienen los científicos, sino que de ella se desprenden las aplicaciones menos sospechadas.
Esta herramienta conocida como CRIPSR-Cas9, que ya lo mencionamos en entradas anteriores [aquí, aquí y aquí], permite insertar genes en lugares específicos del genoma de un organismo, editar y corregir genes defectuosos o eliminar genes indeseados, con una precisión nunca antes lograda.
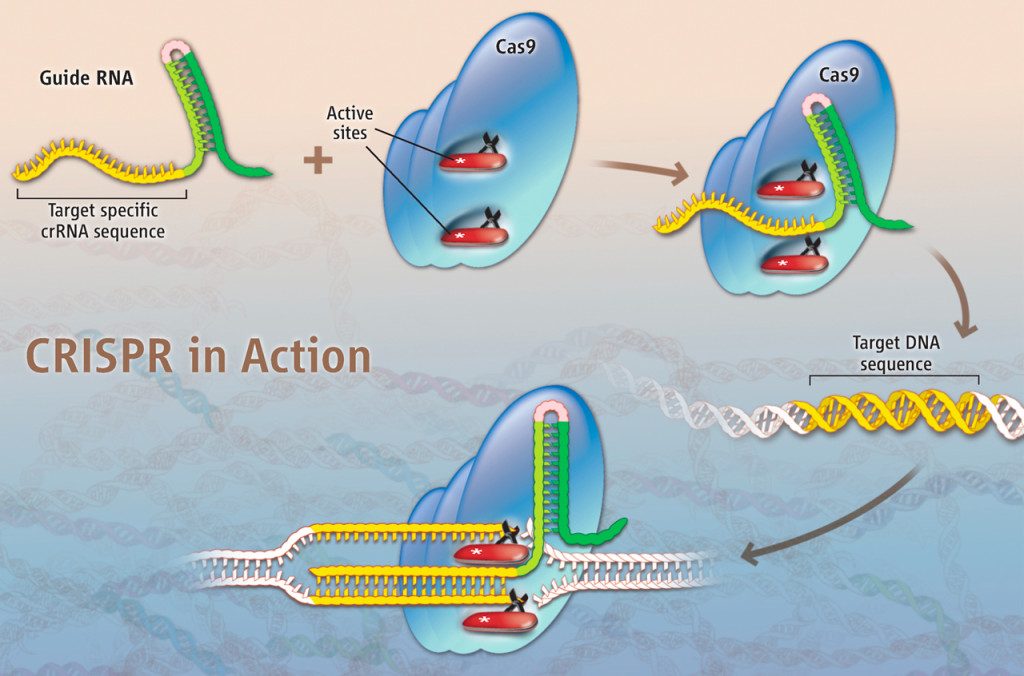
Sistema CRISPR/Cas9 Fuente: E. Pennisi, Science, 341:833-6, 2013. Credito: K. Sutliff/Science
Por ejemplo, el año pasado, un grupo de investigadores del Instituto Tecnológico de Massachusetts, corrigieron una mutación genética en las células del hígado de los ratones que producía una enfermedad hereditaria llamada tirosinemia; la cual también afecta a los humanos y actualmente no tiene cura.
En el 2013, George Church, el pionero de la biología sintética y la genómica personalizada, logró editar genes en diversos tipos de células humanas en el laboratorio, entre ellas, células madre pluripotente inducidas (iPSC) que pueden transformarse en cualquier tejido humano: cardiaco, hepático, cerebral, renal, etc.
Estos estudios nos dan esperanzas de que algún día podremos curar cualquier enfermedad congénita humana, incluso, antes del nacimiento del bebé. Se pueden corregir los errores genéticos en las células germinales (las que producen los óvulos y espermatozoides) del padre o la madre —dependiendo de quién sea el portador— o en las primeras etapas de desarrollo del embrión.
Dado el rápido avance que ha tenido esta tecnología y que ya ha permitido desarrollar monos bebés con genes modificados, un grupo de científicos entre los que se encuentran George Church, Dana Carroll (pionero en la edición de genes por medio de las nucleasas dedos de zinc), Jennifer Doudna (descubridora del funcionamiento de CRISPR-Cas9), Jennifer Puck (pionera en la genómica personalizada), expertos en ingeniería genética y bioética, y algunos premios Nobel, se reunieron el 24 de enero en el valle de Napa, California, para discutir las implicancias que tendría la modificación genética de las células germinales humanas mediante CRISPR-Cas9.
Una preocupación que surgió durante la reunión fue cómo corregir una determinada mutación genética. Les explico. Los estudios de asociación de genoma completo han permitido identificar mutaciones asociadas —en un determinado porcentaje— con ciertas enfermedades humanas. Pero esto no significa que esas mutaciones sean la causa de las enfermedades porque no están presentes en todos los que la padecen. Entonces, si quisiéramos corregir esta mutación, ¿con qué secuencia genética la reemplazaríamos? ¿Aquella variante que es más típica entre las personas sanas? Debemos considerar que no necesariamente podría haber una versión correcta, ya que hay mutaciones neutras, es decir, que no provocan cambios en la proteína que es expresada.
Por otro lado, los científicos coinciden que nuestro entendimiento del genoma humano, la interacción entre los genes y el ambiente (epigenética) y los modos de acción de ciertas enfermedades, sigue siendo muy limitado. Esto podría generar cambios indeseados o no contemplados en las personas que nazcan a partir de células germinales genéticamente modificadas.
Esto no es miedo a la tecnología como hace poco opinó un abogado en este medio. Los mismos pioneros y descubridores de la tecnología, que son los que más conocen acerca de sus alcances y limitaciones, recomiendan la necesidad de entender y manejar los posibles riesgos asociados a la modificación genética de células germinales mediante CRISPR-Cas9. Consideran que se deben establecer protocolos estandarizados para determinar la frecuencia de los efectos no intencionados.
Al optar por una estrategia terapéutica que podría salvar nuestra vida o la de nuestros hijos, podemos asumir grandes riesgos siempre y cuando el beneficio que obtendríamos también es grande; pero no olvidemos que estos riesgos serán justificados solo si la estrategia funciona y es eficiente.
Es así que la reunión celebrada en Napa trajo las siguientes conclusiones respecto a la aplicación de la tecnología CRISPR-Cas9 en células germinales humanas:
1. Desalentar cualquier intento de probar la tecnología en aplicaciones clínicas si antes no se ha discutido, seriamente, entre las organizaciones científicas y gubernamentales, las implicancias sociales, ambientales y éticas de esta actividad.
2. Crear foros, en el que participen científicos y expertos en bioética, para dar información y educación al público general sobre la nueva era de la biología humana, explicando el potencial de esta tecnología para curar muchas enfermedades, así como todos los riesgos y beneficios asociados con ellas.
3. Alentar y fomentar la transparencia en las investigaciones que evalúen la eficacia y especificidad de la tecnología.
4. Convocar a un grupo representativo a nivel mundial, que esté formado por desarrolladores y usuarios de la tecnología; expertos en genética, leyes, bioética; miembros de la comunidad científica, entidades públicas y representantes de la sociedad civil, para generar buenas políticas respecto a esta tecnología.
Los puntos dos y tres, en lo personal, me parecen muy importantes, pues esto no se hizo con la tecnología del ADN recombinante para el desarrollo de los transgénicos, y que ha provocado mucho rechazo a la tecnología, a veces, infundado.
Para concluir, la lección más importante aprendida es que la confianza pública en la ciencia empieza con la transparencia y el debate abierto.
Referencia:
Baltimore D, Berg P, Botchan M, et al. Biotechnology. A prudent path forward for genomic engineering and germline gene modification. Science 348(6230): 36-38 doi: 10.1126/science.aab1028

:quality(75)/2.blogs.elcomercio.pe/service/img/expresiongenetica/autor.jpg)