Comunicación a través del ADN
Como si fueran policías, un amplio grupo de proteínas centinelas patrullan todo nuestro genoma en busca de daños o errores. Sin embargo, la cantidad de proteínas reparadoras no es suficiente como para cubrir toda la longitud de nuestro ADN, el cual se puede dañar hasta un millón de veces cada día, ya sea por la radiación solar (especialmente los rayos UV-B) o los compuestos mutagénicos presentes en los alimentos y el ambiente.

Fuente: Wikimedia Commons.
Sabemos que el trabajo que realizan nuestras células para reparar los errores es muy eficiente. Si no fuera así, cada día nos aparecerían células cancerosas o nuestros órganos se degenerarían rápidamente. Lo que no sabemos es ¿cómo hacen estas proteínas reparadoras para vigilar, en todo momento, los dos metros de ADN que hay en cada una de nuestras células?
Jaqueline Barton, química del Instituto de Tecnología de California (Caltech), tiene una respuesta poco ortodoxa, la cual ha recibido una serie de críticas en los últimos años.
***
En 1953, Watson y Crick revelaban la estructura del ADN. Los químicos de ese entonces notaron que esa conformación en forma de escalera de caracol (técnicamente, una doble hélice) le daba propiedades interesantes al ADN. Las bases nitrogenadas que se hallan hacia la parte interior del esta molécula presentan nubes electrónicas que se superponen unas con otras formando una vía continua para que fluyan los electrones —un cable eléctrico molecular. Sin embargo, los científicos no encontraban signos de que el ADN pudiera conducir la electricidad durante las dos décadas siguientes. Se rindieron.
Fuente: Science.
En 1985, algo interesante ocurrió. Una de las estudiantes de doctorado de Barton en la Columbia University (EEUU) observó que el ADN favorecía el movimiento de electrones a distancia entre diferentes compuestos metálicos.
Hasta ese momento, nadie había encontrado evidencias de esto, incluso ya había quedado zanjada la discusión sobre la conductividad del ADN. ¿Qué había pasado? Barton se dio cuenta que todos los estudios realizados anteriormente se hicieron con la molécula aislada, purificada y cristalizada. ¡Nadie había hecho experimentos de conductividad con el ADN en condiciones fisiológicas! A partir de entonces, empezó a realizar otras pruebas de conductividad en medios que simulan las condiciones que hay dentro de las células obteniendo resultados muy alentadores.
Muchos bioquímicos se mostraron escépticos a sus resultados. Algunos aducían que los metales o los electrodos que usaba la química norteamericana en sus experimentos eran unos artificios que alteraban o mejoraban las propiedades conductivas reales del ADN.
En el 2008, Barton junto al químico Colin Nuckolls, realizan un interesante descubrimiento al conectar dos nanotubos de carbono fijados a electrodos mediante una molécula de ADN. Al encender los electrodos, la corriente eléctrica fluía sin problemas entre los dos nanotubos [número 2 en la figura inferior]. Pero, si la molécula de ADN presentaba errores (malos emparejamientos o ‘mismatch’), la conductividad eléctrica caía dramáticamente [número 1 en la figura inferior].
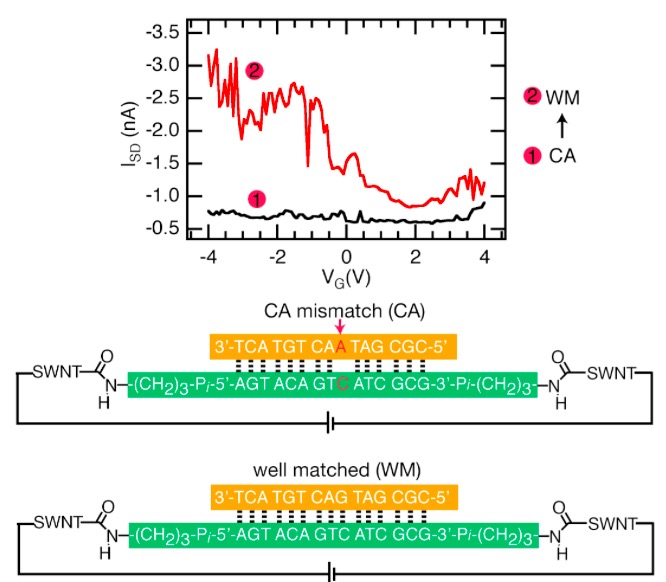
Cuando hay un error en la molécula de ADN (mismatch), la conductividad entre los dos nanotubos de carbono (SWNT) cae considerablemente. Fuente: Nature Nanotechnology.
Barton y sus colegas sospechaban que los cambios en la conductividad del ADN producidos por estos errores eran reconocidos por las proteínas reparadoras para realizar su trabajo.
***
A inicios de la década de 1990, el biólogo John Tainer, hizo un extraño descubrimiento al estudiar una proteína reparadora de ADN llamada Endonucleasa III (Endo III). Dentro de su estructura molecular estaba embebido un complejo molecular de cuatro átomos de hierro y cuatro de azufre (Fe4S4). En algunas proteínas, estos complejos Hierro-Azufre tienen funciones catalíticas (rompen enlaces químicos) gracias a su capacidad de dar y recibir electrones (reacción redox); mientras que en otras, brindan mayor estabilidad a su estructura tridimensional.
Tainer se dio cuenta que en la Endo III, el complejo Hierro-Azufre no tenía una función estructural. Tampoco observó que el grupo Fe4S4 cambiara su estado de oxidación (cediera o recibiera electrones) en presencia de otros compuestos químicos —a menos que estos tuvieran un fuerte potencial redox— por lo que tampoco tendría una función catalítica. Entonces, ¿para qué sirve?
Durante los años siguientes, Barton y sus colaboradores empezaron a unir las piezas de este complejo rompecabezas y a través de un ingenioso experimento observaron que el estado de oxidación del grupo Fe4S4 de la Endo III variaba entre 3+ y 2+ en presencia de ADN. Y no solo eso, cuando estaba en 3+, su afinidad por el ADN era 1000 veces mayor que cuando estaba en 2+.
En base a estos resultados, propusieron una radical interpretación: las proteínas de reparación utilizan al ADN para comunicarse entre sí.
Cuando la Endo III se une al ADN, modifica ligeramente su estructura molecular y el complejo Hierro-Azufre se vuelve más propenso a ceder electrones. Cambia su estado de oxidación de 2+ a 3+ y se vuelve más afín por el ácido nucleico. El electrón liberado viaja a través del ADN hasta encontrar otra Endo III, quien lo acepta y restaura su estado de oxidación original de 2+, desprendiéndose del ADN. Pero, si el ADN presenta algún error, su conductividad se ve afectada y el electrón ya no puede avanzar más. En este caso, la Endo III se mantiene unido al ADN y ejecuta su función reparadora. Esta idea se resume en la siguiente imagen:
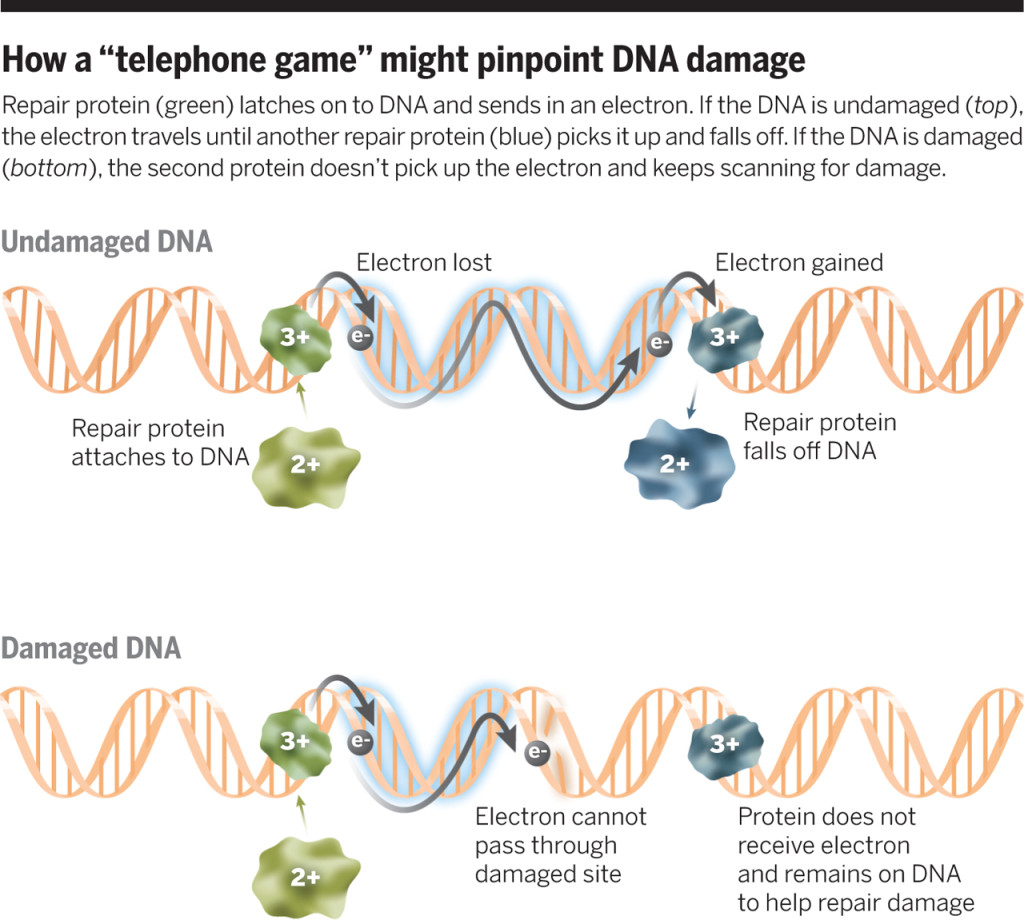
Proceso de reparación propuesto por Barton y colaboradores. i) La Endo III (verde) se une al ADN y libera un electrón. ii) El electrón se desplaza a través del ADN hasta encontrar otra Endo III (azul) unido a este. iii) La Endo III cambia su estado de oxidación de 3+ a 2+ y se desprende del ADN. iv) En caso de daño, el electrón no podrá viajar por el ADN. v) La Endo III permanecerá unida al ADN, buscará el daño y lo reparará. Fuente: Science.
Esta hipótesis ha cobrado más fuerza en los últimos años. Barton ha encontrado evidencias de que la Endo III favorece la función de otras proteínas reparadoras y si es mutada para bloquear su capacidad de ceder electrones, las células se vuelven menos eficientes para encontrar y reparar los errores en el ADN. Y no solo eso, ahora Barton está encontrando estos complejos Hierro-Azufre en otras proteínas que actúan sobre el ADN, por lo que este mecanismo de comunicación se usaría no sólo para reparar el ADN, sino también, para replicarlo y transcribirlo.
Sin embargo, las críticas hacia sus trabajos siguen siendo muy fuertes. Muchos no creen en que el ADN sea usado por ciertas proteínas como un medio para comunicarse entre sí. “Los científicos tienden a ser muy conservadores”, comenta Tainer.
Referencia:
Robert F. Service. Live wire Science 346 (6215): 1284-1287 DOI: 10.1126/science.346.6215.1284
Nota: Por alguna extraña razón no se aprecian los símbolos “más” después de los estados de oxidación 2 y 3.

:quality(75)/2.blogs.elcomercio.pe/service/img/expresiongenetica/autor.jpg)